氧化还原反应计算例题_氧化还原反应高考计算
1.氧化还原反应怎么计算?
2.利用反应Fe+CuSO4═Cu+FeSO4制成一个原电池(正极材料用碳棒),计算:
3.氧化还原反应如何计算电子得失,例如浓硫酸和铜的反应,转移了几个电子?怎么计算.....见下面吧
4.高一化学。。。氧化还原反应计算!!!
5.高一化学、氧化还原反应的计算题、好人帮忙
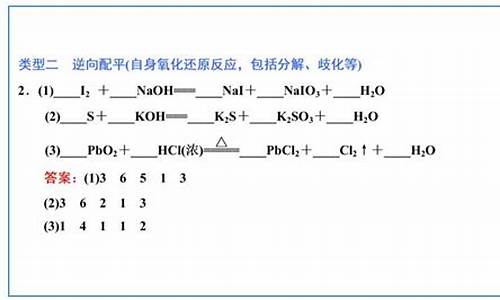
第一个反应没有配平,应该是Cu+4HNO3(浓)==Cu(NO3)2+2NO2+2H2O
Cu由0价变为+2,所以是失2个电子.,这句话是对的,但是在考虑一个反应的得失电子时还应考虑共有多少个铜得失电子,此反应中正好是一个所以是失两个电子。而N由+5变为+4,得一个电子,但是此反应中有两个N变价,所以应该得两个电子
第二个反应
后面的3*2是共有三个氧气分子,每个氧气分子含两个氧原子,相乘就是总共有六个氧原子变价,故变十二价。
氧化还原反应怎么计算?
FeCl3+Ag===FeCl2+AgC。
1、守恒规律
还原剂失电子总数=氧化剂得电子总数=氧化剂化合价降低的总数=还原剂化合价升高的总数。
应用:氧化还原反应方程式的配平和相关计算。
2、强弱规律
还原性:还原剂>还原产物。 ?
氧化性:氧化剂>氧化产物。
应用:物质间氧化性(或还原性)的强弱比较或判断氧化剂和有还原性的物质在一定条件下是否发生反应。
3、先后规律
(1)同一氧化剂与多种还原剂混合,还原性强的先被氧化。
(2)同一还原剂与多种氧化剂混合,氧化性强的先被还原。
应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
4、价态规律
(1)高低规律
元素最高价态:只有氧化性。
元素中间价态:既有氧化性又有还原性。
元素最低价态:只有还原性。
应用:判断物质的氧化性、还原性。
(2)归中规律
①同种元素不同价态之间发生氧化还原反应时,高价态+低价态――→中间价态,即“只靠拢,不交叉”。
②同种元素相邻价态间不发生化学反应。
应用:判断同种元素不同价态的物质间发生氧化还原的可能性。
(3)歧化规律
同种元素的中间价态生成高价和低价,即中间价―→高价+低价。
利用反应Fe+CuSO4═Cu+FeSO4制成一个原电池(正极材料用碳棒),计算:
氧化还原反应方程式的配平是正确书写氧化还原反应方程式的一个重要步骤,是中学化学教学要求培养的一项基本技能。
氧化还原反应配平原则
反应中还原剂化合剂升高总数(失去电子总数)和氧化剂化合价降低总数(得到电子总数)相等,
反应前后各种原子个数相等。
下面介绍氧化-还原反应的常用配平方法
观察法
观察法适用于简单的氧化-还原方程式配平。配平关键是观察反应前后原子个数变化,找出关键是观察反应前后原子个数相等。
例1:Fe3O4+CO ? Fe+CO2
分析:找出关键元素氧,观察到每一分子Fe3O4反应生成铁,至少需4个氧原子,故此4个氧原子必与CO反应至少生成4个CO2分子。
解:Fe3O4+4CO 3Fe+4CO2
有的氧化-还原方程看似复杂,也可根据原子数和守恒的思想利用观察法配平。
例2:P4+P2I4+H2O ? PH4I+H3PO4
分析:经观察,由出现次数少的元素原子数先配平。再依次按元素原子守恒依次配平出现次数较多元素。
解:第一步,按氧出现次数少先配平使守恒
P4+P2I4+4H2O ? PH4I+H3PO4
第二步:使氢守恒,但仍维持氧守恒
P4+P2I4+4H2O PH4I+H3PO4
第三步:使碘守恒,但仍保持以前调平的O、H
P4+5/16P2I4+4H2O ? 5/4PH4I+H3PO4
第四步:使磷元素守恒
13/32P4+5/16P2I4+4H2O 5/4PH4I+H3PO4
去分母得
13P4+10P2I4+128H2O 40PH4I+32H3PO4
2、最小公倍数法
最小公倍数法也是一种较常用的方法。配平关键是找出前后出现“个数”最多的原子,并求出它们的最小公倍数
例3:Al+Fe3O4 ? Al2O3+Fe
分析:出现个数最多的原子是氧。它们反应前后最小公倍数为“3? 4”,由此把Fe3O4系数乘以3,Al2O3系数乘以4,最后配平其它原子个数。
解:8Al+3Fe3O4 4Al2O3+9Fe
3:奇数偶配法
奇数法配平关键是找出反应前后出现次数最多的原子,并使其单(奇)数变双(偶)数,最后配平其它原子的个数。
例4:FeS2+O2 ? Fe2O3+SO2
分析:由反应找出出现次数最多的原子,是具有单数氧原子的FeS2变双(即乘2),然后配平其它原子个数。
解:4FeS2+11O2 2Fe2O3+8SO2
4、电子得失总数守恒法
这种方法是最普通的一方法,其基本配平步骤课本上已有介绍。这里介绍该配平时的一些技巧。
(栈┱?宸?/P>
对某些较复杂的氧化还原反应,如一种物质中有多个元素的化合价发生变化,可以把这种物质当作一个整体来考虑。
例5:
FeS+H2SO4(浓) Fe2(SO4)3+S+SO2+H2O
分析:先标出电子转移关系
FeS+H2SO4 1/2Fe2(SO4)3+S+SO2+H2O
该反应中FeS中的Fe,S化合价均发生变化,可将式中FeS作为一个“整体”,其中硫和铁两元素均失去电子,用一个式子表示失电子总数为3e。
2FeS+3H2SO4 Fe2(SO4)3+2S+3SO2+H2O
然后调整未参加氧化还原各项系数,把H2SO4调平为6H2SO4,把H2O调平为6H2O。
解: 2FeS+6H2SO4 Fe2(SO4)3+2S+3SO2+6H2O
(二)零价法
对于Fe3C,Fe3P等化合物来说,某些元素化合价难以确定,此时可将Fe3C,Fe3P中各元素视为零价。零价法思想还是把Fe3C,Fe3P等物质视为一整价。
例7:
Fe3C+HNO3 ? Fe(NO3)3+CO2+NO2+H2O
Fe3C+HNO3 Fe(NO3)3+CO2+NO2+H2O
再将下边线桥上乘13,使得失电子数相等再配平。
解:
Fe3C+22HNO3(浓) 3Fe(NO3)3+CO2+13NO2+11H2O
练习:
Fe3P+HNO3 Fe(NO3)3+NO+H3PO4+H20
得3Fe3P+41HNO39Fe(NO3)3+14NO+3H3PO4+16H2O
(三)歧化反应的配平
同一物质内同一元素间发生氧化-还原反应称为歧化反应。配平时将该物质分子式写两遍,一份作氧化剂,一份作还原剂。接下来按配平一般氧化-还原方程式配平原则配平,配平后只需将该物质前两个系数相加就可以了。
例8:
Cl2+KOH(热)? KClO3+KCl+H2O
分析:将Cl2写两遍,再标出电子转移关系
3Cl2+6KOH KClO3+5KCl+3H2O
第二个Cl2前面添系数5,则KCl前需添系数10;给KClO3前添系数2,将右边钾原子数相加,得12,添在KOH前面,最后将Cl2合并,发现可以用2进行约分,得最简整数比。
解:
3Cl2+6KOH KClO3+5KCl+3H2O
(四)逆向配平法
当配平反应物(氧化剂或还原剂)中的一种元素出现几种变价的氧化—还原方程式时,如从反应物开始配平则有一定的难度,若从生成物开始配平,则问题迎刃而解。
例9:
P+CuSO4+H2O Cu3P+H3PO4+H2SO4
分析:这一反应特点是反应前后化合价变化较多,在配平时可选择变化元素较多的一侧首先加系数。本题生成物一侧变价元素较多,故选右侧,采取从右向左配平方法(逆向配平法)。应注意,下列配平时电子转移都是逆向的。
P+CuSO4+H2O Cu3P+H3PO4+H2SO4
所以,Cu3P的系数为5,H3PO4的系数为6,其余观察配平。
解:
11P+15CuSO4+24H2O 5Cu3P+6H3PO4+15 H2SO4
5、原子个数守恒法(待定系数法)
任何化学方程式配平后,方程式两边各种原子个数相等,由此我们可以设反应物和生成物的系数分别是a、b、c 。
然后根据方程式两边系数关系,列方程组,从而求出a、b、c 最简数比。
例10:KMnO4+FeS+H2SO4? K2SO4+MnSO4+Fe2(SO4)3+S+H2O
分析:此方程式甚为复杂,不妨用原子个数守恒法。设方程式为:
aKMnO4+bFeS+cH2SO4 d K2SO4+eMnSO4+fFe2(SO4)3+gS+hH2O
根据各原子守恒,可列出方程组:
a=2d (钾守恒)
a=e(锰守恒)
b=2f(铁守恒)
b+c=d+e+3f+g(硫守恒)
4a+4c=4d+4e+12f+h(氧守恒)
c=h(氢守恒)
解方程组时,可设最小系数(此题中为d)为1,则便于计算:得a=6,b=10,d=3,
e=6,f=5,g=10,h=24。
解:6KMnO4+10FeS+24H2SO4 3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
例11:Fe3C+HNO3 ? CO2+Fe(NO3)3+NO+H2O
分析:运用待定系数法时,也可以不设出所有系数,如将反应物或生成物之一加上系数,然后找出各项与该系数的关系以简化计算。给Fe3C前加系数a,并找出各项与a的关系,得
aFe3C+HNO3 aCO2+3aFe(NO3)3+(1-9a)NO+1/2H2O
依据氧原子数前后相等列出
3=2a+3? 3? 3a+2? (1-9a)+1/2 a=1/22
代入方程式
1/22 Fe3C+HNO3 1/22CO2+3/22Fe(NO3)3+13/22NO+1/2H2O
化为更简整数即得答案:
Fe3C+22HNO3 CO2+3Fe(NO3)3+13NO+11H2O
6、离子电子法
配平某些溶液中的氧化还原离子方程式常用离子电子法。其要点是将氧化剂得电子的“半反应”式写出,再把还原剂失电子的“半反应”式写出,再根据电子得失总数相等配平。
例11、KMnO4+SO2+H2O ? K2SO4+MnSO4+H2SO4
分析:先列出两个半反应式
KMnO4- +8H+ +5e Mn2+ + 4H2O ?
SO2 + 2H2O - 2e SO42- + 4H+ ?
将 2, 5,两式相加而得离子方程式。
2KMnO4+5SO2+2H2O K2SO4+2MnSO4+2H2SO4
下面给出一些常用的半反应。
1)氧化剂得电子的半反应式
稀硝酸:NO3- +4H+ + 3e NO + 2H2O
浓硝酸:NO3- +2H+ + e NO2 + H2O
稀冷硝酸:2NO3- +10H+ + 8e N2O + H2O
酸性KMnO4 溶液:MnO4- + 8H+ + 5e Mn2+ + 4H2O
酸性MnO2:MnO2 +4H+ + 2e Mn2+ + 2H2O
酸性K2Cr2O7溶液:Cr2O72- +14H+ + 6e 2Cr3+ + 7H2O
中性或弱碱性KMnO4 溶液:MnO4- + 2H2O + 3e MnO2? + 4OH-
2)还原剂失电子的半反应式:
SO2 + 2H2O - 2e SO42- + 4H+
SO32- + 2OH- - 2e SO42- + H2O
H2C2O4 - 2e 2CO2? +2H+
7、分步配平法
此方法在浓硫酸、硝酸等为氧化剂的反应中常用,配平较快,有时可观察心算配平。先列出“O”的设想式。
H2SO4(浓) SO2 + 2H2O +[O]
HNO3(稀) 2 NO+H2O +3[O]
2HNO3(浓) 2 NO2+H2O + [O]
2KMnO4+ 3H2SO4 K2SO4+2MnSO4+ 3H2O+5[O]
K2Cr2O7+ 14H2SO4 K2SO4+Cr2(SO4)3+ 3 [O]
此法以酸作介质,并有水生成。此时作为介质的酸分子的系数和生成的水分子的系数可从氧化剂中氧原子数目求得。
例12: KMnO4+ H2S + H2SO4 ? K2SO4+2MnSO4+ S + H2O
分析:H2SO4为酸性介质,在反应中化合价不变。
KMnO4为氧化剂化合价降低“5”, H2S化合价升高“2”。它们的最小公倍数为“10”。由此可知,KMnO4中氧全部转化为水,共8个氧原子,生成8个水分子,需16个氢原子,所以H2SO4系数为“3”。
氧化还原反应如何计算电子得失,例如浓硫酸和铜的反应,转移了几个电子?怎么计算.....见下面吧
解题思路:(1)由反应可知,生成1molCu转移2mol电子,以此计算;(2)n(Cu)=n(CuSO4),结合c=nV计算.
(1)由Fe+CuSO4=Cu+FeSO4~2e-可知,生成1molCu转移2mol电子,则转移电子1mol,则生成铜为1mol×[1/2]×64g/mol=32g,答:生成Cu为32g;(2)n(Cu)=n(CuSO4)=0.5mol,则c(CuSO4)=[0.5mol/0.1L]=5 mol∕L,答:CuSO4的物质的量浓度为5mol/L.
点评:本题考点: 氧化还原反应的计算;物质的量浓度的相关计算;氧化还原反应. 考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中转移电子与物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.
高一化学。。。氧化还原反应计算!!!
Cu+2H2SO4=CuSO4+SO2+H2O
铜从0价变成+2价,失去两个电子;硫酸中的硫从+6价变成二氧化硫中的+4价,得到2个电子。
再比如:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
铜从0价变成+2价,失去2*3=6个电子;HNO3中的N原子从+5价变成+2价,得到3个电子,在2个N原子化合价有变化,得到的电子数=3*2=6个。
高一化学、氧化还原反应的计算题、好人帮忙
这是一个简单的得失电子守恒的计算题
我将这种题目的解法步骤写给你看 你就会了
化合价升高
S:+4→+6 失电子总数为2e-*24*0.05mol = 2.4mole-
化合价降低
Cr:+6→x 得电子总数为(6-x)e-*20*0.02*2mol(特别注意最后的这个2 因为一个K2Cr2O7中含有2个+6价的Cr元素)
得失电子守恒 (6-x)e-*20*0.02*2mol= 2.4mole-
解得x=3
1、由于参加反应的HCl为16mol,但是化合价发生变化的(也就是被还原的)为10mol,而参加反应的还原剂KMnO4全部被氧化为2mol,所以反应中氧化剂和还原剂的物质的量之比为1:5
在KMnO4里Mn的化合价为+7价,MnCl2里Mn的化合价为+2价,化合价升降为5,即在此反应中1molKMnO4转移电子5mol;在HCl里Cl的化合价为-1价,Cl2里化合价为0价,化合价升降为1,即在此反应中1molHCl转移电子1mol;根据电子守恒,假设氧化剂的物质的量为x,还原剂的物质的量为y,则有5x=y,得x:y=1;5,即反应中氧化剂和还原剂的物质的量之比为1:5。希望这样解释你能明白...
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。