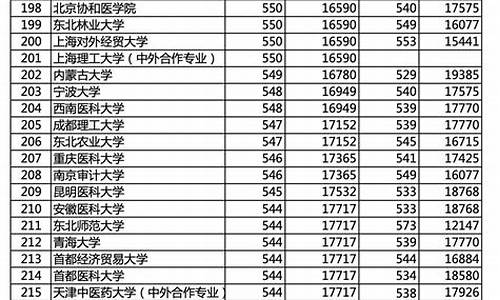
金属天津高考,天津高考化学
1.天津春招高考能抄到吗
2.2009天津高考物理题求助
3.2023年天津津南区中考分数线
4.天津自考作弊会记入考生诚信档案吗?
5.今年高考总人数2023
6.2019年天津高考化学压轴试卷及答案
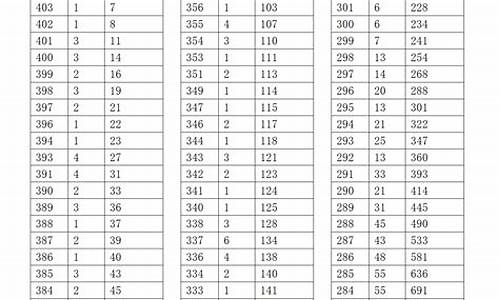
报名时间为8月23至9月1日。
2019年天津成人高考专业
1、高起专专业:建筑工程技术、工程造价、市场营销、学前教育、小学教育、法律事务、护理、中药学、计算机应用技术、财务管理、酒店管理、工商企业管理、艺术设计、机电一体化技术、会计、电子商务、人力资源管理、金融管理、行政管理、电子信息工程技术、国际经济与贸易、数字媒体艺术设计、汽车检测与维修技术等。
2、专升本专业:土木工程、建筑学、测绘工程、工程管理、城市管理、工商管理、市场营销、财务管理、行政管理、生物科学、机械工程、车辆工程、电气工程及自动化、金融学、工程经济学、中医学、临床医学、汉语言文学、生物科学、电子商务、公共事业管理、汽车服务工程、无机金属材料工程、生物医学、新能源材料与器件、机械设计制造及其自动化等。
3、高起本专业:土木工程、环境工程、建筑学、电气工程及其自动化、工程管理、法学、学前教育、汉语言文学、英语、市场营销、财务管理、物业管理、机械电子工程、医学检验技术、政治学与行政学、环境设计、园林、康复治疗学、电气工程及自动化、计算机科学与技术、生物医学工程、人力资源管理、公共事业管理、金融学、国际经济与贸易。
天津春招高考能抄到吗
相对原子质量:H 1 Li 7 C 12 O 16 Br 801.化学与生活密切相关,下列有关说法正确的是A.维生素C具有还原性,在人体内起抗氧化作用B.糖类、蛋白质、油脂属于天然高分子化合物C.煤经气化和液化两个物理变化过程,可变为清洁能源D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料A解析还原性的物质有抗氧化作用,A项正确;B项,糖类不属于高分子,错;C项,煤气化属于化学变化,错;D项,聚酯纤维属于有机物,错。 2. 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是A.均存在电离平衡和水解平衡B.存在的粒子种类相同C.c(OH-)前者大于后者D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大C解析相同浓度时,Na2CO3的碱性强于NaHCO3,C项错。 3.下列实验设计和结论相符的是A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液B解析A项,乙醇不可以作为萃取剂,错;B项,石蕊变蓝,则肯定为碱性,正确。C项,若原溶液中含有SO32 -,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,故错;D项,加热时,FeCl3会水解,错。 4.下列叙述正确的是A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小C.pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降D解析A项,苯酚钠为碱性溶液,故错;B项,温度不变,则Kw是不变的,错;C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确。 5.人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2O2+HbCO ,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是A.CO与HbO2反应的平衡常数K=B.人体吸入的CO越多,与血红蛋白结合的O2越少C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动C解析由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。,由题意知,K=220,=0.02时,人受损,则C(CO)/C(O2)=9×10-5,C项错。D项,当O2浓度很大时,题中平衡将逆向移动,从而解救人,正确。 6.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+ ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法正确的是A.CO的燃烧热为283 kJB.右图可表示由CO生成CO2的反应过程和能量关系C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/molD.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023C解析A项,燃烧热的单位出错,应为Kj/mol,错;图中的量标明错误,应标为2molCO和2molCO2,故错。CO2气体的能量大于固体的能量,故C项中放出的能量应小于452KJ,而?8?5H用负值表示时,则大于-452Kj/mol,正确;将下式乘以2,然后与上式相加,再除以2,即得CO与Na2O2的反应热,所得热量为57KJ,故D项错。7.(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:族周期IA 01①ⅡAⅢAⅣAⅤAⅥAⅦA 2 ②③④ 3⑤ ⑥⑦ ⑧ (1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:X溶液与Y溶液反应的离子方程式为_____________________,N→⑥的单质的化学方程式为________________。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。 解析本题以周期表为题材,考查原子半径比较,酸性强弱,电子式,离子方程式以及盐类水解等知识。(1)⑤⑥位于同一周期,且⑤排在⑥的前面,原子半径大,而④在上一周期,比⑤、⑥少一个电子层,故半径最小。(2)②⑦位于同一主族,上面的非金属性强,最高价含氧酸酸性强,②③位于同一周期,且③在后,非金属性强,对应的酸性强。(3)四种元素分别为氢、氧、钠和氯,离子键显然必须是钠盐,极性共价键则应有两种非金属组成。(4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。(5)⑥为Al,可推断Z为Al(OH)3,受热分解可产物Al2O3,再电解即可得单质铝。M仅含非金属的盐,显然铵盐,所以X与Y应为AlCl3与NH3·H2O的反应,生成NH4Cl。由于NH4+ 水解,故要使其浓度与Cl-相等,则要补充NH3·H2O。由电荷守恒知:C(NH4+ )+ C(H+)C(Cl-)+C(OH-),若C(NH4+ ) C(Cl-),则C(H+)= C(OH-),即pH=7。8.(18分)请仔细阅读以下转化关系:A.是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;B.称作冰片,可用于医药和制香精,樟脑等;C.的核磁共振氢谱显示其分子中含有4种氢原子;D. 中只含一个氧原子,与 Na反应放出H2 ;F.为烃。请回答:(1) B的分子式为_______________________。(2) B不能发生的反应是(填序号)______________。a.氧化反应 b.聚合反应 c.消去反应 d取代反应 e.与Br2加成反应.(3) 写出D→E、E→F的反应类型:D→E__________________、E→F_______________________。(4) F的分子式为____________________。 化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构;_______________________________________________________________________。(5) 写出A、C的结构简式并用系统命名法给F命名:A:___________________、C: 、F的名称:__________________。(6) 写出E→D的化学力程式______________________________________________________________________。 解析本题考查有机物的推断。F是相对分子质量为70的烃,则可计算14n=70,得n=5,故其分子式为C5H10。E与F的相对分子质量差值为81,从条件看,应为卤代烃的消去反应,而溴的相对原子质量为80,所以E应为溴代烃。D只含有一个氧,与Na能放出H2,则应为醇。A为酯,水解生成的B中含有羟基,则C中应含有羧基,在C、D、E、F的相互转变过程中碳原子数是不变,则C中碳应为5个,102-5×12-2×16=10,则C的化学式为C5H10O2,又C中核磁共振谱中含有4种氢,由此可推出C的结构简式为:(CH3)2CHCH2COOH。(1)从B的结构式,根据碳四价被全氢原子,即可写出化学式。(2)B中有羟基,则可以发生氧化,消去和取代反应。(3)C到D为羧基还原成了羟基,D至E为羟基被溴取代生成溴代烃。溴代烃也可在NaOH水溶液中取代成醇。(4)F为烯烃,其同系物D也应为烯烃,又相对分子质量为56,则14n=56,得n=4。所有同分异构体为1-丁烯,2-丁烯(存在顺反异构)和甲基丙烯四种。(5)B为醇,C为羧酸,两者结合不写出A的酯的结构。F的名称要注意从靠近碳碳双键的一端进行编号命名。(6)E→D为溴代烃,NaOH水溶液条件下的取代反应。9.(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:(1)请列举海水淡化的两种方法: 、 。(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:请你参与分析讨论:①图中仪器B的名称: 。②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。 解析本题考查海水中提取溴的实验。电解NaCl溶液的方程式为:2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。10.(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。(2)负极反应式为 。(3)电极表面镀铂粉的原因为 。(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w.k.s.5.u.c.o.mⅠ.2Li+H22LIHⅡ.LiH+H2O==LiOH+H2↑①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。 ③32解析本题考查电化学知识。(1)原电池的实质为化学能转化成电能。总反应为2H2 + O2 =2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。(3)铂粉的接触面积大,可以加快反应速率。(4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)= 192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子。
2009天津高考物理题求助
不能。天津春招高考考场是最严格的考场。进场之前,一共要经过三道工序。第一道在门口,老师拿着一份整个考场的名单(上面带有照片),跟你的准考证信息对照,确认无误方可进门。第二道,老师拿着金属探测器,一直扫到不响为止才放你进去。第三道,有一个指纹和面部识别器,把手和脸放进去,监考老师再次对照信息,所以天津春招高考不能抄。作弊轻则考试成绩作废,会被记录在失信手册上,作弊严重或者涉及范围大的情况,很有可能被判刑。
2023年天津津南区中考分数线
你听说过超导现象吧,说明对于金属来说,温度越低,R越小,,由于电流的热效应,电流越大,温度就越高,
你说的根据欧姆定律电流越大电阻越小,是在电压一定情况下。小灯泡变亮,是由于功率变大?与电阻没直接关系、
天津自考作弊会记入考生诚信档案吗?
2023年天津津南区中考分数线是468.5分。
中考是相对比较重要的考试,其次于高考,考试是高度紧张的思维活动,一定要保持良好的精神状态上考场,是考试正常发挥的必要前提。而且,中考也有很多注意事项:
1、中考考试前一天下午一定要去看考场,看自己所在考场的具体位置,查看洗手间在哪里,方便节约时间。尽量提前出发到达考点,以防路上有特殊情况的发生。早点出门,防止迟到,迟到是进不去考场的。
2、出门前一定要检查好准考证和身份证,这两个证件缺一不可,一定要再三确认是否带齐全了。考试前一天晚上一定要早睡,不可暴饮暴食,也不能不吃或少吃。保持肚子不饿,有精力做题。检查考试要穿的衣服和鞋子,一定不能带金属。尽量穿质感较好且舒服的运动休闲装,减少因天气炎热而产生的焦躁不安心理。
3、克服心理和生理难关应考时,思想上不要把考场看成多么特别的地方,想一想我们都“身经百战”,这次考试不也是我们经常经历的考试中的一场吗。答题时,应遵循先易后难的规律。遇到难题时若已仔细读题三遍还没一点思路,就应跳过去做下一道。
答题间隙也可看一看窗外景色,调节一下紧张的情绪。若一道题花了10分钟还做不出来,那就放弃,因为你不会,别人也不一定会,扔一道题没什么。最后当其他题目均已完成时,还可以换一个角度重读一遍该题,说不定会“柳暗花明又一村”呢。
4、正确对待第—科考试俗话说万事开头难,第一科考试,无论你考下来的自我感觉如何,过早的喜悦和泄气都是非常有害的。
相信自己的实力和能力,马上转入后面的考试才是正确的策略。就像我们在群岭中爬山一样,刚刚越过的那一个山头的险峻已经不十分重要了,因为无论你是从顶峰越过还是在山腰绕过,都已经落在了我们身后,重要的是面前的这座山该怎样去攀登。
今年高考总人数2023
天津自考作弊会记入考生诚信档案吗
在天津自考中违纪作弊情况将被记入考生诚信档案。
天津自考各考点将配备一定数量身份证鉴别仪、二代身份证阅读器、手机探测狗、金属探测仪或手机屏蔽仪等现代化设备,防范打击“枪手”等大面积作弊的违规行为。
对违纪作弊的天津自考考生,除取消本次考试成绩外,第二年不允许再报考。违纪作弊情况记入考生诚信档案。
自学考试制度
高等教育自学考试是个人自学和国家考试相结合的高等教育形式,是我国社会主义高等教育体系的重要组成部分。是贯彻宪法鼓励自学成才的有关规定,造就和选拔德才兼备的专门人才,提高全民族的思想道德素质和科学文化素质,以适应社会主义现代化建设的需要。与普通高考和成人高考在招生对象、考试时间及学制不同,自考是“宽进严出”。考生参加国家考试机构统一组织的单科考试,合格一门,发一门的合格证书,所有科目合格后,方可申请毕业(申请本科毕业的学生还需提供国家承认的专科毕业证)。自考是一种自主学习的过程,只有亲身体验过,尤其是只有其中一少部分善于学习的考生才是自考的最终胜出者(毕业)。学生在经过系统的学习后,通过毕业论文答辩、学位英语考核达到规定成绩,符合学位申请条件的,可申请授予学士学位。并可继续攻读硕士学位和博士学位。
自考国际认可
我国高等教育自学考试的教育质量得到国际社会的普遍认可,全世界有40多个国家和地区承认我国的高等教育自学考试文凭,美国、日本、新西兰、新加坡、法国、印度、比利时、俄罗斯、马来西亚、菲律宾、西班牙、德国、乌克兰、南非、荷兰、波兰、丹麦、爱尔兰、瑞典、瑞士、韩国等国家(和中国香港澳门地区)及几乎所有英联邦国家的大学都承认我国的自考学历,对自考学历与普通高校的学历同等对待。允许持有学历证书或单科《课程合格证书》的自考生进入相关院校学习,或攻读学位或免修、减修部分课程。
自学考试制度是世界上规模最大的、最能体现终身教育理念和学习型社会特点的开放式高等教育制度,它以国家考试为主导,以个人自主学习为基础,是富有中国特色的“没有围墙的大学”,是自学成才的摇篮。
自考/成考有疑问、不知道如何总结自考/成考考点内容、不清楚自考/成考报名当地政策,点击底部咨询官网,免费领取复习资料: style="font-size: 18px;font-weight: bold;border-left: 4px solid #a10d00;margin: 10px 0px 15px 0px;padding: 10px 0 10px 20px;background: #f1dada;">2019年天津高考化学压轴试卷及答案
2023高考总人数1291万考生报名,比去年增加98万人,再创历史新高。从已公布的2023年高考报名人数看,多地较去年报名人数有所增加。如湖南高考报名人数达68.4万人,比上年增加2.9万人;四川省报考人数超过80万,两省报名人数均创历史新高。
教育部会同国家教育统一考试工作部际联席会议成员单位,统筹谋划,周密部署,指导各地精心做好考试组织和考生服务工作。安徽铜陵10个考点442个考场准备工作已就绪,一些考点在不同位置安放了布局图并有专人引导讲解,对行动不便的考生还开放了电梯便捷通道,配备专人全程服务。
今年是实施新冠“乙类乙管”后的首次高考,教育部提示考生,建议继续做好个人防护,当好自身健康第一责任人,考前尽量减少聚集和流动,不去人员密集场所。多地发布了考场防疫的提示信息。北京市教育考试院发布提示,考生应做好自我健康监测,如出现发热、咳嗽等不适症状应及时向报名单位(所在中学)报告。
多地发布高考考前提示和考场规则,表示今年将加强高考安检。北京、江西、湖南长沙等地考生考前需经过两次安检,手机、智能手表、智能手环等电子设备禁止带入考点。教育部提示,考生的衣着要符合当地考试机构的相关要求,建议不佩戴含有金属成分的手镯、项链、发夹等佩饰物品。
2023年采用新高考模式的省份地区同2022年相同,北京、上海、山东、浙江、海南、天津采用“3+3”新高考模式,辽宁、福建、湖北、湖南、江苏、广东、河北、重庆采用“3+1+2”模式,各省考试时间为2天、3天、4天不等。
2023年高考形势
1、高考报名人数持续增长,竞争不断加剧。2023年高考报名人数超过1000万,再创新高。高校招生计划却相对稳定,这意味着每位考生面临的竞争将更加激烈。尤其是211和985院校,录取难度将进一步增加。这也要求考生更加努力,在各项能力与成绩上有较大提高,以在竞争中脱颖而出。
2、理科更加优势,文科可选范围收窄。随着我国产业升级,理工科人才更加紧缺。这使得理科的升学机会与就业前景相对较好。相比而言,文科的发展前景略显不及,可选的升学范围也较为有限。所以,理科考生面临较小的压力,录取机会也更大;而文科考生需要更广泛覆盖可选院校,以确保升学机会。
3、新高考改革加大高校自主权,录取方式更加多元。随着新高考制度逐步推行,高校在招生中获得更大自主权,录取方式也更加多元化。除高考成绩外,高校还关注考生的综合素质与特长才艺。这要求考生早做准备,在各方面发掘并充实自身优势,以增加被更优秀院校青睐的机会。本科录取不再过于依赖分数,眼光也需要更加开阔,这是高考生需要适应的重要方向。
2019年天津高考化学压轴试卷及答案
第Ⅰ卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共6小题,每题6分,共36分。在每题列出的四个选项中,只有一项是最符合题目要求的。
以下数据可供解题时参考:H 1? O 16? Na 23? S 32? Cl 35.5
1. 下列说法正确的是
A.可用金属钠除去乙醇溶液中的水
B.萃取碘水中的碘单质,可用乙醇做萃取剂
C.我国西周时发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理
D.汽油中加入适量乙醇作汽车燃料,可节省石油资源,减少汽车尾气对空气的污染
2. 下列对有关实验操作及现象的结论或解释正确的是
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。