高考电离水解_电离 水解
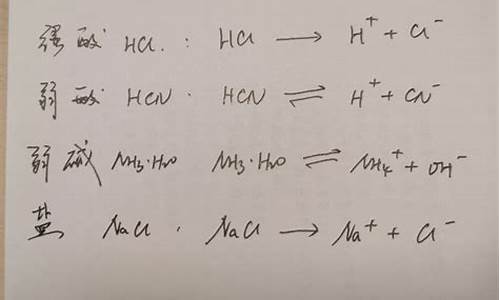
假设,溶液中全是HClO分子(都没有电离),虽然水解常数大于电离常数,你说此时电离平衡向哪个方向移动?显然朝电离方向移动啊。既然朝电离方向移动,那么原来是中性的水,不就是酸性了吗。
关键是你没弄懂概念,水解常数大于电离常数可以说明什么?可以说明在溶液中,同时存在等量(比如都是1mol)的次氯酸(单独存在呈酸性)和次氯酸钠(单独存在呈碱性)时溶液会呈现碱性。
这是一个平衡问题,这种问题最好的办法是极限思维解决,类似我第一段的思想。
没看懂的话可以追问。
盐类水解看电解质本身性质啊,强酸弱碱盐,一般电离>水解,显酸性,强碱弱酸盐,一般水解>电离,显碱性,强酸强碱盐不存在水解,一些弱酸弱碱盐在高中阶段是不做要求的,记住一句很有用的口诀:有弱才水解,越弱越水解,谁强显谁性,你可以对照相应习题以及本本,看看规律,很容易记的,有些东西是要背下来比较好,考试的时候没那么多时间想,常见的盐类有的是要记住的,不然到高三复习时,你就得狂补化学咯
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。